原肌球蛋白受體激酶(TRK)家族屬于受體酪氨酸激酶,主要參與神經組織的發育和功能調控。TRKs包括TRKA、TRKB和TRKC三個亞型,分別由NTRK1、NTRK2和NTRK3基因編碼。到目前為止,已經被發現并報道的NTRK基因畸變有染色體易位、基因擴增、點突變和選擇性剪接等,這些變化會導致TRK通路組成型激活,促進細胞增殖、存活和惡性轉化。在TRK激活的不同分子機制中,NTRK基因的染色體易位研究最為頻繁,比較典型的是由于染色體異位重排引起的NTRK基因的3'區域與伴侶基因的5'區域相連,最終導致TRK激酶磷酸化并激活下游信號通路,從而調控細胞的生長、分化、凋亡等過程。至今,TRK融合已經被發現存在于許多人類惡性腫瘤中,包括肺癌、結直腸癌和軟組織肉瘤等,這其中,TMP3-TRKA是最常見的融合之一。此外,TRK融合似乎是一些罕見癌癥的主要促癌因素,如嬰兒纖維肉瘤、分泌性乳腺癌、和類似乳腺的分泌性癌(MASC)。

圖1幾種常見的TRK抑制劑
經過科研人員長期的努力,目前已經有兩種TRK抑制劑(圖1-A1:larotrectinib(拉羅替尼);圖1-A2:entrectinib(恩曲替尼))被FDA批準用于部分攜帶NTRK融合基因的癌癥病人的治療,雖然這兩種藥均表現出了不錯的臨床效果,但同時也產生了一些不良反應,如頭暈、感覺異常、體重增加等,其中的一些不良反應被認為是藥物抑制了大腦中的野生型TRK信號導致的結果。此外,據報道,病人在使用這些藥物后產生了耐藥性,因此,研究者們渴望開發一種新的藥物作用機制來更持久地抑制TRK通路,同時減少不良反應。
近年來,使用降解劑對目標蛋白水平進行化學下調以此來治療疾病的策略已經成為研究的熱點,許多降解劑已顯示出了超過酶抑制劑的優勢,因為它們不僅會抑制靶蛋白的酶活性,而且會耗盡靶蛋白的骨架和其他非催化功能,此外,由于降解劑的催化性質,可以避免高暴露量,從而改善潛在的不利影響。2019年,研究者們報道了一種野生型TRKC降解劑,它能夠在胞外域結合野生型TRKC并達到降解蛋白的目的。但顯然,只針對胞外結構域的TRK降解劑在治療癌癥中的應用是有限的。最近,本研究論文的作者們在類似物3和廣譜TRK抑制劑4(GNF-8625)的基礎上,設計并合成一系列TRK降解劑,通過構效關系研究確定了兩種靶向激酶胞內結構域的高效選擇性降解劑5(CG416)和6(CG428)。
基于化合物3-TRKA結構域復合物的共晶結構與化合物3和GNF-8625的細胞活性數據(TRKAIC50= 3nM),研究者認為化合物3和GNF-8625都能有效地與TRKA結合,考慮到兩者的分子量,最終選擇化合物3為TRK結合部分來設計降解劑,為了便于合成,在吡啶的2號位引入哌嗪以便后續的連接,選擇pomalidomide作為E3連接酶配體,因其相比于VHL具有更小的分子量和潛在更優的PK性質。

圖2化合物合成
在上述基礎上,研究者們設計合成了帶有各種碳鏈連接子或聚乙二醇(PEG)連接子的降解劑(圖2),并進行了SAR研究(圖3):

圖3含不同連接子降解劑的SAR研究
在KM12細胞系中的實驗數據顯示(圖3),用10nM濃度降解劑處理6小時后,上述合成的所有化合物都能顯著降低TPM3-TRKA水平。當降解劑濃度降低至1nM甚至是0.1nM,化合物6表現出相比其它化合物更優異的降解效果,此外,化合物5和6在結構上相似,僅僅只有一個原子的差異,選擇這兩個化合物進行進一步的生物學表征有助于研究降解劑微妙的結構變化與其降解效力之間的關系。

圖4化合物5和6對TRKs的親和力實驗
對抑制劑GNF-8625、降解劑5和6及其對照化合物25和26與TRKA、TRKB和TRKC的親和力進行評估發現,與GNF-8625相比,降解劑5和6對TRKs的親和力略有下降,而在降解劑5和6末端的pomalidomide上引入甲基對親和力沒有太大的影響(圖4)。實驗結果表明,對GNF-8625溶劑暴露區域的結構進行修飾改造總體是可行的。

圖5化合物5和6的TRK降解能力實驗
在KM12細胞系中對化合物5和6的測試結果表明(圖5),兩種化合物在較低濃度時均能明顯下調TPM3-TRKA水平,同時抑制下游PLCγ-1磷酸化,而PLCγ-1蛋白水平不受影響,這說明降解劑對PLCγ-1蛋白磷酸化的抑制效果并不是通過下調PLCγ-1蛋白水平實現的(圖5-A)。進一步的動力學實驗顯示,這兩種化合物均在0.3h內就能明顯地觀察到對TPM3-TRKA蛋白的降解效果以及對PLC的磷酸化抑制效果(圖5-B)。此外,在HEL細胞系中,化合物5和6都顯示出了高效降解野生型TRKA的能力(圖5-C),相反,對照化合物25和26在30nM時依然無法降解HEL細胞中的野生型TRKA。

圖6化合物5和6的選擇性實驗
為了評估化合物5和6對TRK家族其它成員的降解效力,研究者們測試了兩種化合物在KM12細胞系中分別對AGBL4-TRKB和ETV6-TRKC的降解效果(圖6)。比較意外的是,與TRKB親和力更弱的化合物5,反而表現出比化合物6更好的AGBL4-TRKB降解效果,這說明親和力不是決定降解劑降解效力的唯一因素。總的來說,兩種化合物對AGBL4-TRKB和ETV6-TRKC的降解效果均遠不如對TPM3-TRKA的降解效果(圖6A,Bvs 圖5A),而且在降解劑濃度為500nM時,還觀察到了鉤狀效應。

圖7化合物5和6抑制細胞增殖實驗
此外,相比GNF-8625和化合物25、26,化合物5和6抑制KM12細胞增殖的效果要好很多,其IC50值分別達到了5.4nM和2.9nM(圖7)。

圖8ICR小鼠實驗
為了進一步考察化合物5和6的生物可利用性,該論文作者評價了兩種分子在小鼠體內的PK性質(圖8)。數據顯示,在1h左右,兩種化合物的血漿暴露量均達到峰值,分別約為2050nM(5)和1640nM(6),而且這兩種化合物的血漿濃度在8h后依然遠高于它們各自在KM12細胞中的DC50值(分別為0.48nM和0.36nM),最重要的是,在PK測試期間,沒有觀察到臨床癥狀,這些結果均有助于進一步的體內研究。
基于GNF-8625類似物3與TRKA復合物的共晶結構,研究者們設計并合成了一系列具有不同連接子類型的可能的蛋白降解分子,通過SAR研究確定了兩個降解效果優秀且結構相似的分子5和6。進一步的研究表明,5和6均表現出與TRKs較高的親和性,并在KM12細胞中均以濃度和時間依賴的方式選擇性下調TPM3-TRKA融合蛋白水平,而對AGBL4-TRKB和ETV6-TRKC這兩種融合蛋白的降解效果較差。此外,化合物5和6均表現出了相比于GNF-8625更好的抗細胞增殖作用,在小鼠體內也都顯示出良好的血漿暴露水平。
參考文獻
LiqunChen, Yanke Chen, Chunyan Zhang, Bingyang Jiao, Sheng Liang, QiongTan, Hongyu Chai, Weihua Yu, Yongzheng Qian, Hui Yang, Wuyi Yao,Jianguo Yu, Ying Luo, Michael Plewe, Jialiang Wang, Xiao-Ran Han, andJing Liu Discovery of First-In-Class Potent and Selective Tropomyosin
ReceptorKinase Degraders Journalof Medicinal Chemistry(2020),Ahead of Print. DOI: 10.1021/acs.jmedchem.0c01342
[1]Molecular Pharmaceutics(2019),16(10),4313-4318.
注:文中圖片均來源于參考文獻
-
產品編號: 1020445
CAS: 13526-66-4
-
產品編號: 1053327
CAS: 923595-49-7
-
產品編號: 1067937
CAS: 298690-72-9
-
產品編號: 1118265
CAS: 260367-12-2
-
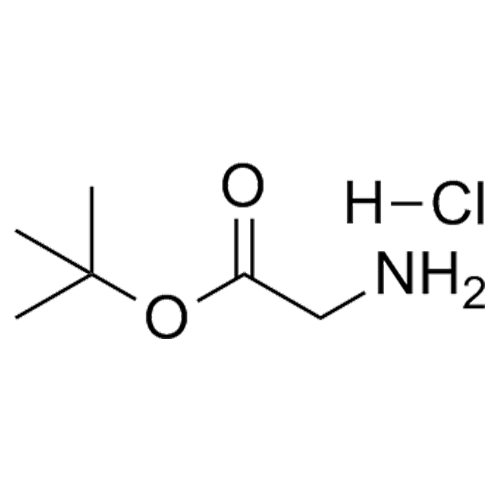
產品編號: 1028119
CAS: 27532-96-3
-

產品編號: 1036724
CAS: 58620-93-2
-
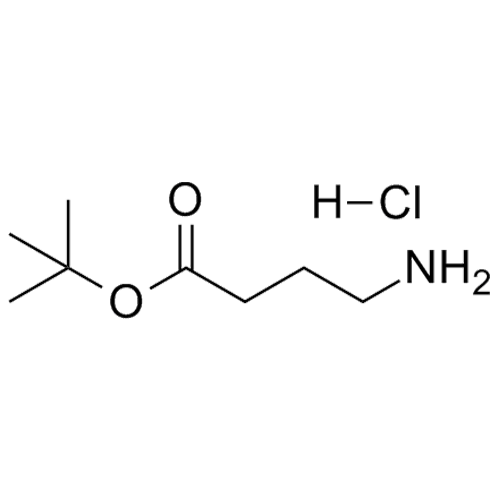
產品編號: 1063256
CAS: 58640-01-0
-

產品編號: 1067237
CAS: 5514-98-7
-
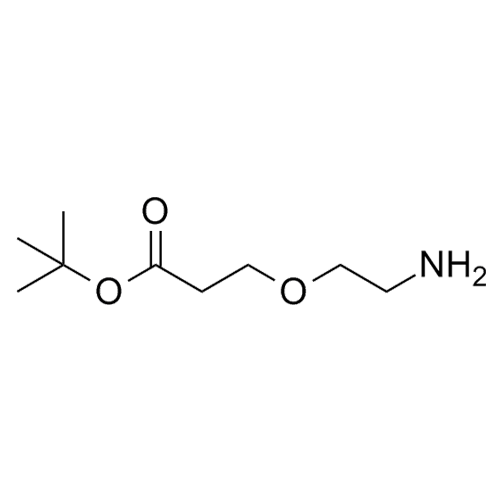
產品編號: 1129936
CAS: 1260092-46-3
-
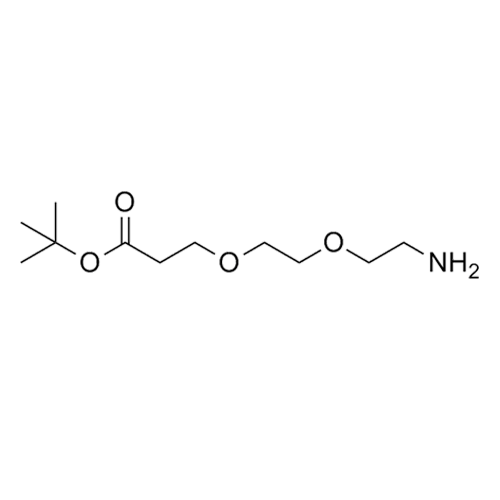
產品編號: 1105774
CAS: 756525-95-8
-
產品編號: 1164168
CAS: 57078-98-5
-

產品編號: 1035870
CAS: 55750-53-3
 技術支持
技術支持




 400-821-0725
400-821-0725





















 滬ICP備17019645號
滬ICP備17019645號








 久久久久精品国产麻豆
久久久久精品国产麻豆