 相關研究
相關研究
張緒穆教授在不對稱氫化和手性膦配體研究領域已經有二十多年的研究經歷,并且取得了豐碩的研究成果。張緒穆教授是全球磷化學領域的權威專家,曾經連續兩次受邀在第16屆和17屆國際磷化學會議上做大會報告(2004年在英國伯明翰;2007年在中國廈門)。張緒穆教授開發的手性工具箱廣泛應用于不對稱氫化、不對稱氫甲酰化反應等領域,在不對稱催化領域具有廣泛的國際影響力,其中DuanPhos、Binapine、TangPhos、TunePhos等配體在國際上應用較為廣泛。
1. 剛性、富電子手性雙膦配體的開發與應用

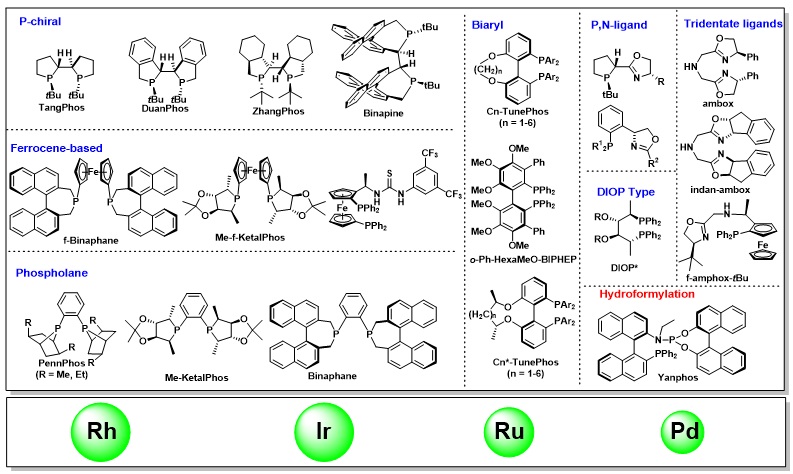
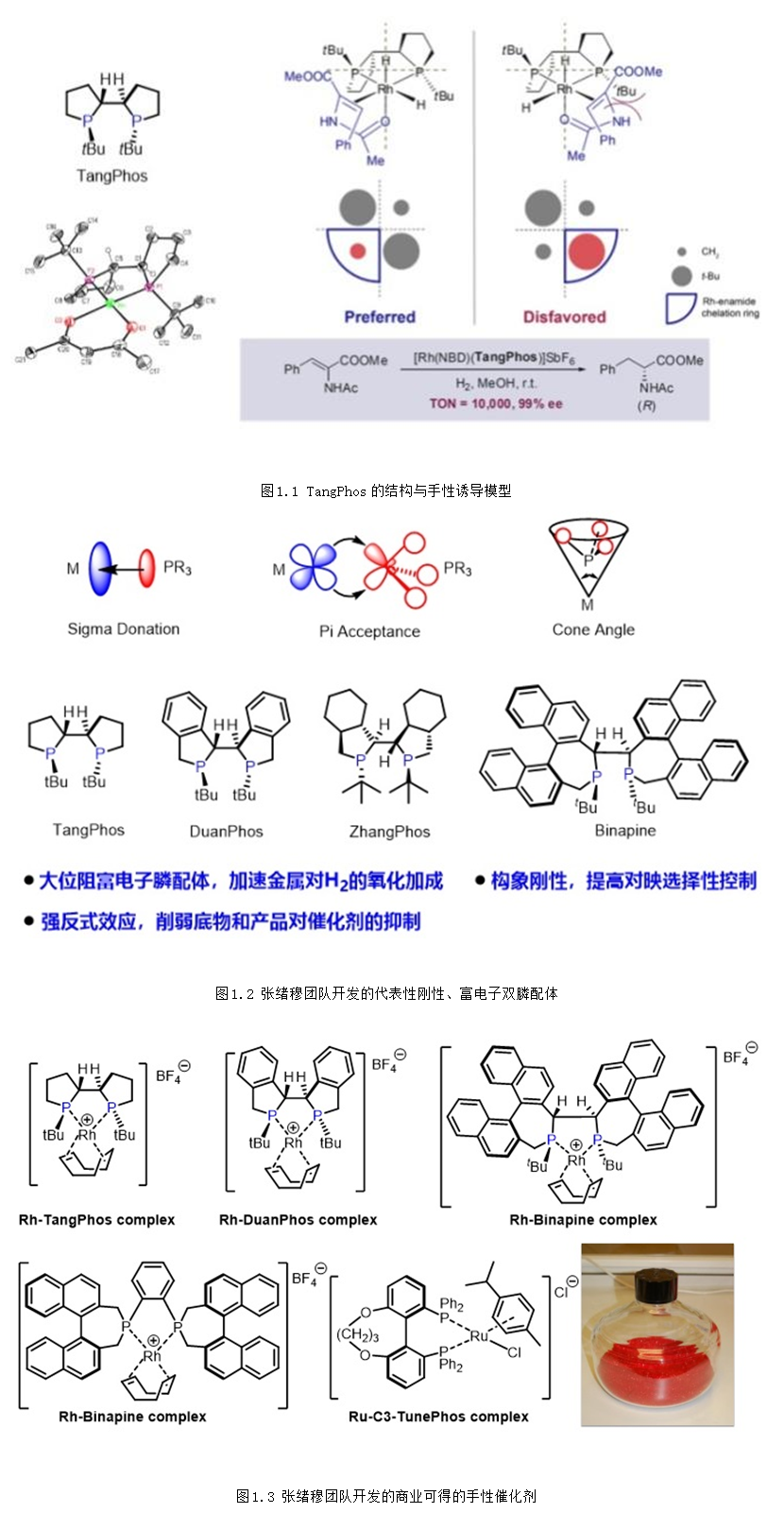
張緒穆教授在手性配體的合成和應用方面做出了許多開創性的工作,發展了系列剛性、富電子的三烷基雙膦配體,如TangPhos、DuanPhos、Binapine等應用于銠金屬的不對稱氫化。該類富電子膦配體能夠加速一價Rh對氫氣的氧化加成,提高反應性(圖1.2)。同時,強的反位效應可以減少產物抑制,提高轉化數。由于配體的剛性,能給出很好的立體選擇性。以上幾種特性,使得該類配體成為銠金屬不對稱氫化中的超實用配體,廣泛應用于凱瑞斯德生化(蘇州)有限公司工業化生產,其中多個配體的金屬絡合物已經成為商業可得的高效金屬催化劑,可以從試劑公司Strem或Aldrich購買得到(圖1.3)(Acc. Chem. Res. 2020, 53, 1905–1921; Acc. Chem. Res. 2007, 40, 1278-1290; Chem. Rev. 2003, 103, 3029-3069; Chin. J. Chem. 2020, 38, 954-968)。
2. 基于二茂鐵骨架的超高效手性多齒配體的開發與應用

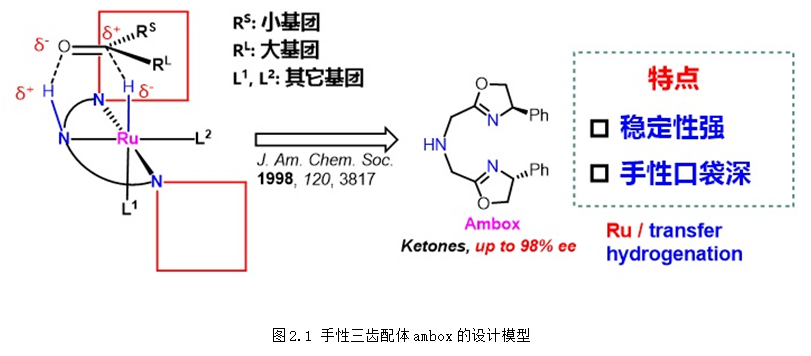
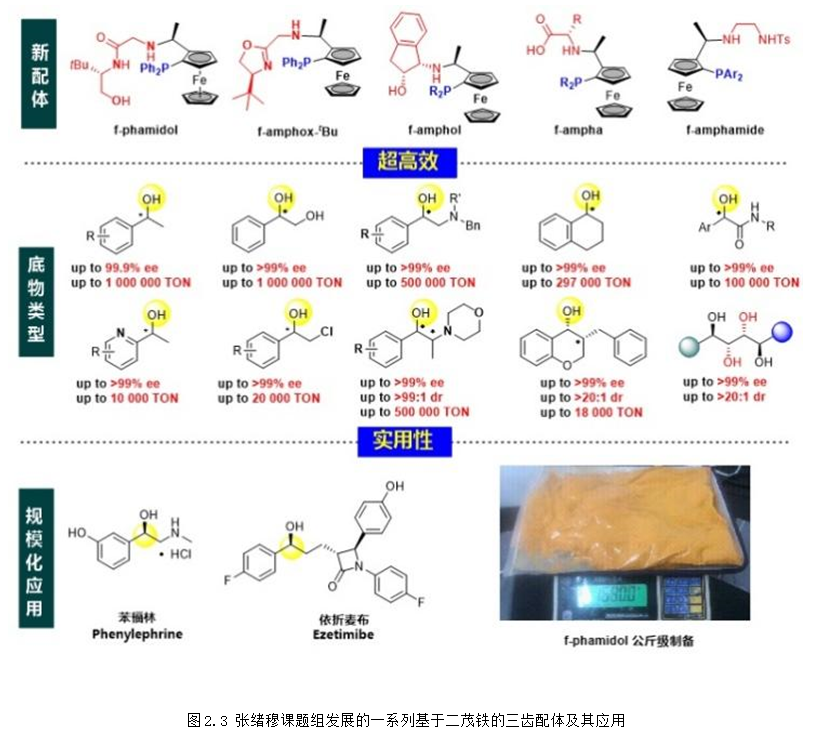
上個世紀90年代,張緒穆教授在國際上率先將手性三齒配體應用于簡單酮不對稱(轉移)氫化。1998年,首次發展的三齒配體ambox在不對稱轉移氫化、不對稱轉移氫化中表現出優異的對映選擇性控制。從2016年開始,以廉價的Ugi胺為手性原料,陸續發展了f-amphox、f-amphol、f-ampha、f-amphamide等一系列容易合成、結構可調的二茂鐵骨架手性三齒配體,在羰基化合物的不對稱氫化中表現超高的催化效率 (TON:1,000,000) 和對映選擇性 (>99% ee),含膦大位阻二茂鐵骨架的引入不僅提高了配體的活性和選擇性,也使得配體更加穩定和更加容易修飾。
和Noyori的催化體系相比,張緒穆團隊發展的三齒配體具有以下特點:(1) 形成的銥催化劑異常穩定;(2) 具有超高的反應活性;(3) 配位飽和有效地阻止了產物的抑制作用。此外,三齒配體對堿的容忍性更好,具有更高的催化效率,更廣的底物適用范圍。
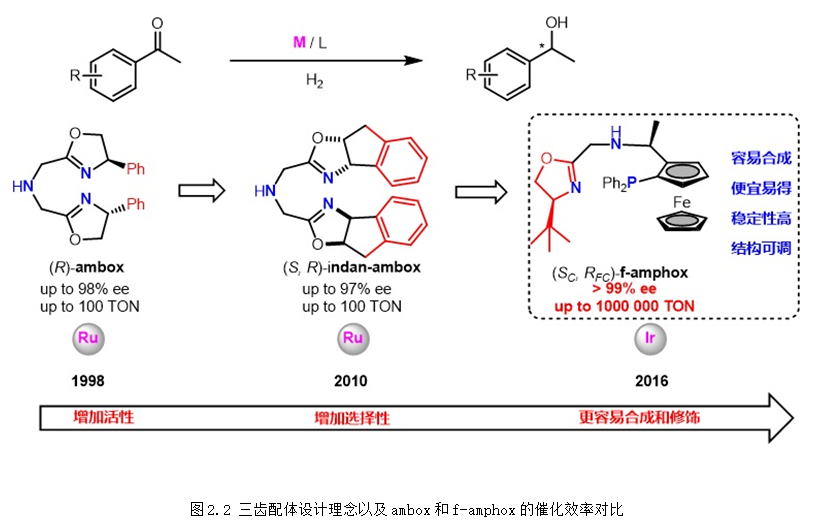
基于二茂鐵骨架的手性三齒配體在銥催化酮的不對稱氫化中展示出了超高的催化效率和非常寬的底物普適性(圖2.3)。目前,手性三齒配體f-phamidol已經實現了公斤級規模的生產,并被成功應用于依折麥布、苯福林、孟魯司特等多種重大藥物關鍵中間體的高效合成中。
3. 基于“非共價鍵相互作用”策略發展新型的手性雙膦配體

過渡金屬催化的不對稱反應的發展高度依賴于手性配體的發展,為了進一步提高不對稱催化反應的對映選擇性和反應活性,發展更為高效、更為實用同時易于合成和對空氣穩定的手性膦配體具有重要意義。非共價鍵相互作用在催化劑的設計中扮演著重要的角色,能夠穩定反應的過渡態,減少過渡態中的自由度,降低反應的活化能。代表性的非共價鍵相互作用有空間排斥作用、氫鍵和離子對相互作用,其中氫鍵和離子對相互作用較強。基于“非共價鍵相互作用”策略,張緒穆研究團隊將氫鍵和離子對相互作用引入到手性雙膦配體中,發展新型高效的手性雙膦配體,2020年,張緒穆團隊在Acc. Chem. Res.上對該部分工作進行詳細的介紹 (Acc. Chem. Res. 2020, 53, 1905-1921)。

4. 過渡金屬催化的不對稱還原胺化

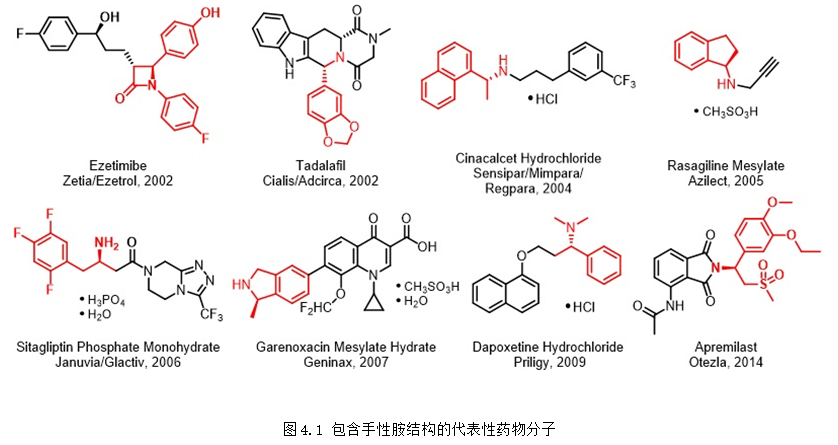
手性胺結構廣泛存在于天然產物和藥物分子中。特別是最近20年開發出的新藥中,手性胺得到了越來越多的應用(圖4.1)。不僅如此,在新型手性藥物、農藥以及日化品的設計、合成和開發中,手性胺骨架也是考察和使用最多的類型之一。此外,手性胺在有機合成特別是手性胺配體合成以及作為有機小分子催化劑等領域應用也十分廣泛。由于其重要性,開發高效、高選擇性和經濟性的策略構建手性胺吸引了化學家們極大的關注。
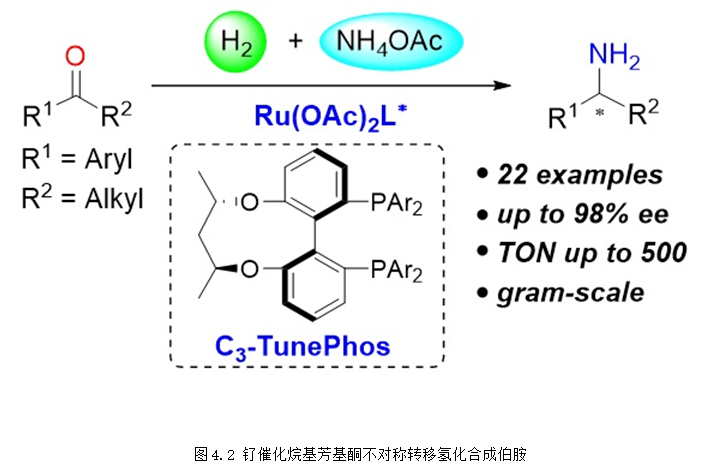
2018年,張緒穆課題組利用無機氨鹽為胺源,釕的C3*-TunePhos絡合物為催化劑,氫氣為還原劑,實現了簡單芳基酮的不對稱還原胺化,通過該方法可以高效合成得到手性伯胺產物(圖4.2)。該反應具有非常重要的應用價值,目前已被成功應用于重大藥物西那卡塞關鍵中間體的不對稱合成當中 (J. Am. Chem. Soc. 2018, 140, 2024-2027),該研究工作被Synfacts雜志選為亮點進行評述 (Synfacts 2018, 14, 0504)。
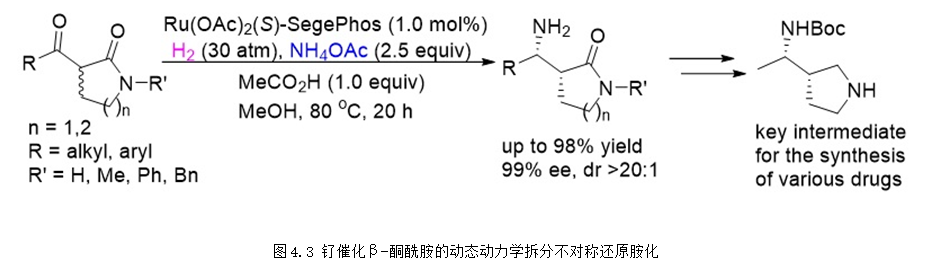
同年,張緒穆課題組也實現了環狀β-酮酰胺的動態動力學拆分不對稱還原胺化,能夠以高達98%的收率99%的ee值合成得到手性伯胺產物,該產物經過簡單的轉化就可以合成得到許多藥物的關鍵中間體 (圖4.3),具有非常好的實用價值 (Angew. Chem. Int. Ed., 2018, 57, 14193-14197)。
5. 手性氧雜螺環配體的設計、合成與應用

由于其結構上的剛性和穩定性,螺環配體越來越得到有機合成化學家的重視。特別是南開大學周其林課題組的研究工作,更是將螺環配體的發展推向了高潮,使手性螺環配體在短短的數十年間發展成為一類應用廣泛的優勢結構配體。周其林課題組最具代表性的手性配體是SpiroPAP,該配體的銥的絡合物在簡單酮的不對稱氫化中可以獲得高達99.9%的對映選擇性和4,550,000的TON,創造了不對稱氫化領域TON的最高紀錄 (Angew. Chem. Int. Ed., 2011, 50, 7329-7332)。

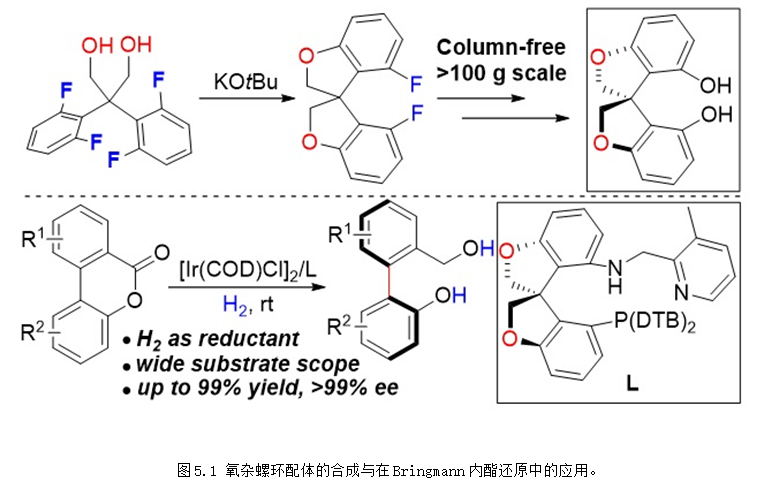
但是螺環配體也存在骨架結構單一等缺點。為了克服上述難題,2018年,張緒穆課題組以分子內的雙重芳香親核取代為關鍵步驟高效合成得到了一種新型氧雜螺環二酚骨架O-SPINOL,并以O-SPINOL為起始原料合成得到了O-SpiroPAP配體,該配體在Bringmann內酯的動態動力學拆分不對稱還原中表現出優異的反應活性和對映選擇性 (圖5.1) (J. Am. Chem. Soc. 2018, 140, 8064-8068),該研究工作被Synfacts雜志選為亮點進行評述 (Synfacts 2018, 14, 1050)。
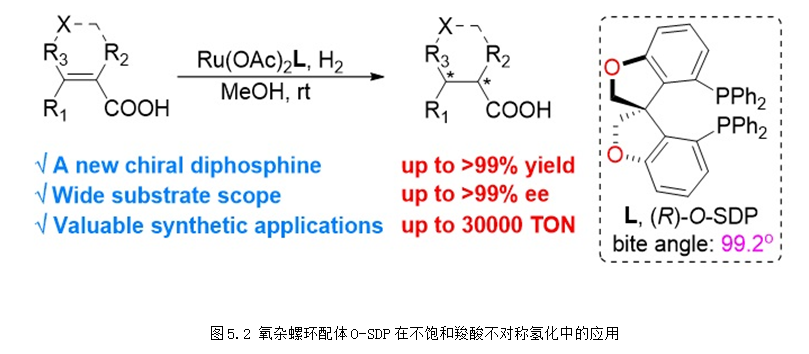
此外,基于O-SPINOL骨架的氧雜螺環雙膦配體O-SDP在α,β-不飽和羧酸的不對稱氫化中表現出優異的反應活性和選擇性。此外該配體的釕的絡合物可以用于重大藥物沙庫必曲的不對稱合成中,具有非常重要的應用價值 (圖5.2) (CCS Chem., 2020, 2, 468-477)。
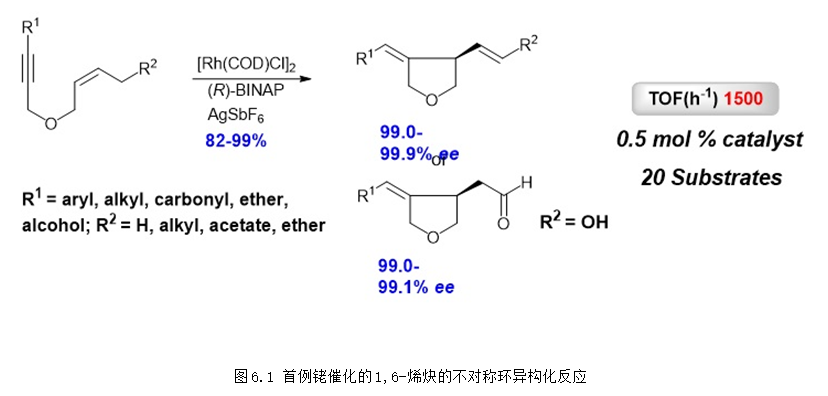
6. 銠催化的不對稱烯炔環異構化反應 (張烯炔環異構化反應)

過渡金屬催化的烯炔環異構化反應是構建環狀化合物非常高效的方法,早在2000年,張緒穆課題組研究發現1,6-烯炔底物在銠-雙膦配體催化劑的作用下可以以非常高的區域選擇性得到五元雜環或者碳環化合物,該反應是首例銠催化的1,6-烯炔環異構化反應 (Angew. Chem. Int. Ed. 2000, 39, 4104-4106)。后續的研究發現采用BINAP作為手性配體就可以得到非常高的對映選擇性,并且該反應具有非常廣泛的底物適用范圍,2016年,張緒穆團隊成功將該反應的底物適用范圍由順式雙鍵底物擴展到了更常見的反式雙鍵底物。
2014年3月,張緒穆教授的研究成果“烯炔的環異構化反應”,被冠以“張”姓,命名為“Zhang enyne cycloisomerization”。該成果已被國際化學權威著作Name Reactions 收錄,成為以中國人名命名的為數不多的人名反應之一(圖6.2)。
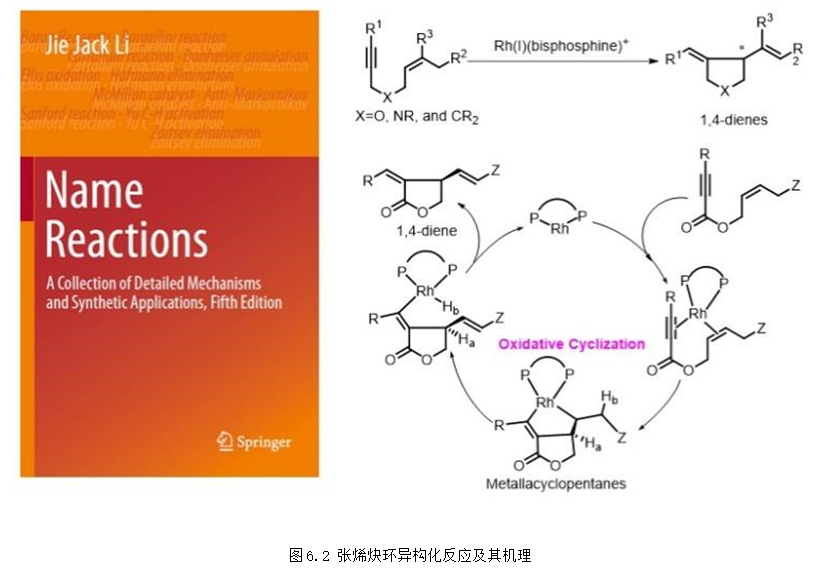
"張烯炔環異構化反應"有著廣泛的適用性和實用性,利用該反應可以方便的實現烯烴和炔烴分子內的不對稱環化,高效地構筑了一系列五元雜環化合物,在生物活性分子以及藥物分子的合成中有重要的應用。例如,世界著名的有機化學家Nicolaou教授用張緒穆教授發展的人名反應實現了復雜活性分子平板霉素的全合成 (J. Am. Chem. Soc. 2009, 131, 16905-16918)。張緒穆團隊也采用該合成方法實現了Kainic acid的高效不對稱合成 (Chem. Commun. 2018, 54, 727-730)。
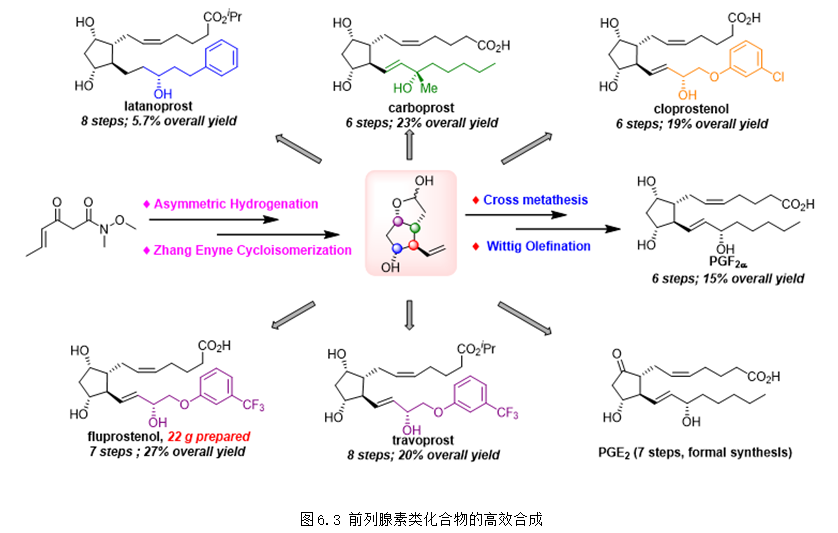
2021年,張緒穆團隊在烯炔環異構化領域再次取得重要進展,以三齒配體銥絡合物催化的烯酮不對稱氫化和課題組發展的“烯炔環異構化”反應為關鍵步驟實現了系列前列腺素和相關藥物的簡潔、高效不對稱全合成,將合成步驟縮短到了6步,極大地提高了合成效率,并且實現了20克規模合成氟前列醇 (fluprostenol),相關研究成果發表在Nat. Chem.上 (Nat. Chem. 2021, 13, 692-697)。前列腺素是一類具有廣泛生物活性的激素類物質,具有非常好的成藥性,目前,在世界范圍內有超過20種前列腺素類上市藥物。該研究成果極大地提高了前列腺素類化合物的合成效率,對前列腺素相關藥物的研究具有重要意義(圖6.3)。

7. 銠催化的不對稱氫甲酰化反應

氫甲酰化反應是以烯烴和合成氣為原料高效合成醛類化合物的重要反應。由于醛類化合物在工業合成中有著極其重要的應用,氫甲酰化反應被學術界和工業界廣泛研究,并已發展成為當今工業上規模最大的均相催化反應之一。據統計,全球通過氫甲酰化生產醛、醇的能力已經達到千萬噸規模。相比較而言,利用手性催化劑合成手性醛的不對稱氫甲酰化反應的發展卻比較緩慢,目前還沒有工業應用的報道。手性配體對于不對稱氫甲酰化反應的活性、化學選擇性和對映選擇性都有顯著影響,目前能夠應用于不對稱氫甲酰化反應的手性配體的種類非常有限,新型手性配體的開發是該領域最具挑戰性的難題,在該領域中有將近一半的手性配體都是張緒穆研究團隊開發的(圖7.1)。
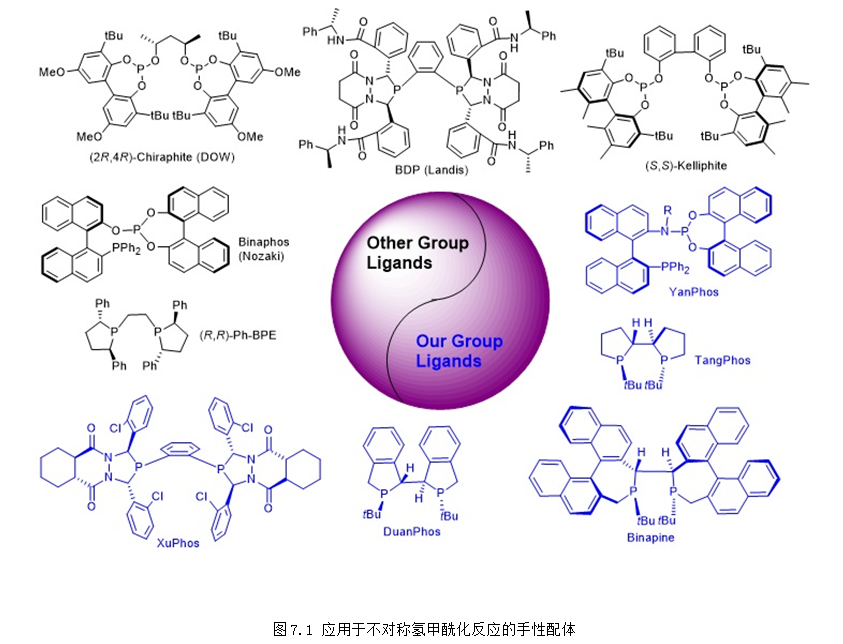
張緒穆教授開發的YanPhos是在不對稱氫甲酰化反應中應用最為廣泛的手性配體之一,在多種底物類型的不對稱氫甲酰化反應中表現出優異的反應活性和對映選擇性:(1) YanPhos在4-取代環戊烯類底物的去對稱化不對稱氫甲酰化反應中表現出優異的反應活性和対映選擇性 (up to 96% yield, up to >99:1 dr, up to 97% ee; Angew. Chem. Int. Ed., 2016, 55, 6511-6514)。(2) YanPhos在1,2-二取代硅基烯烴的不對稱氫甲酰化反應中表現出優異的區域選擇性和對映選擇性 (up to 98% yield, up to >99:1 dr and up to 97% ee; Nat. Commun. 2018, 9, 2045)。(3) YanPhos在挑戰性底物1,1-二取代烯烴的不對稱氫甲酰化反應中表現出優異的區域選擇性和對映選擇性 (J. Am. Chem. Soc, 2018, 140, 4977-4981)。

 技術支持
技術支持




 400-821-0725
400-821-0725


















 滬ICP備17019645號
滬ICP備17019645號







